Ferrochelatase (auch: Häm-Synthase) ist ein Enzym in Eukaryoten und den meisten Bakterien, das den letzten Teilschritt der Synthese des Häm, die Chelatierung von Protoporphyrin IX mit einem Eisen-II-Ion, katalysiert. Da die Reaktion bei Eukaryoten in den Mitochondrien bzw. Chloroplasten stattfindet, muss Protoporphyrin zuvor in diese Kompartimente transportiert werden; der genaue Ablauf des Transports ist noch unklar. Beim Menschen führen Mutationen am FECH-Gen zu Ferrochelatasemangel, welcher für die seltene Erbkrankheit erythropoetische Protoporphyrie verantwortlich ist. In Archaeen und sulfatreduzierenden Bakterien, die Häm nach einem alternativen Syntheseweg herstellen, wurde das Eisen-chelierende Enzym noch nicht identifiziert.
Katalysierte Reaktion
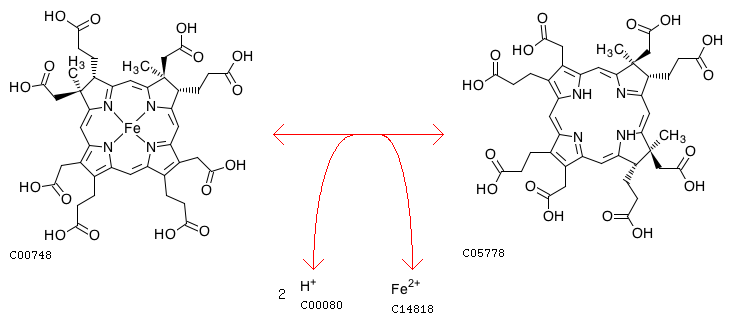
Fe2 ⇔ 2H
Protoporphyrin IX wird mit Eisen-II cheliert, Protonen werden abgespalten, Häm b entsteht. Umgekehrt kann das Enzym auch die Entfernung des Metallions beim Abbau verschiedener Häme katalysieren. Als Cofaktor fungiert ein Eisen-Schwefel-Cluster. Rekombinante Ferrochelatase ist in der Lage, auch andere zweiwertige Metallionen wie Kobalt, Nickel, Zink oder Kupfer zu chelieren.
Weblinks
- Jassal, D’Eustachio / reactome: Ferrous iron is inserted into protoporphyrin IX to form heme
Einzelnachweise