Vilobelimab ist ein Arzneistoff aus der Gruppe der monoklonalen Antikörper. Unter dem Namen Gohibic (Hersteller: InflaRx) wurde er im Januar 2025 in der Europäischen Union zugelassen zur Behandlung eines durch eine Infektion mit SARS-CoV-2 („Coronavirus“) ausgelösten akuten Atemnotsyndroms (ARDS).
Eigenschaften
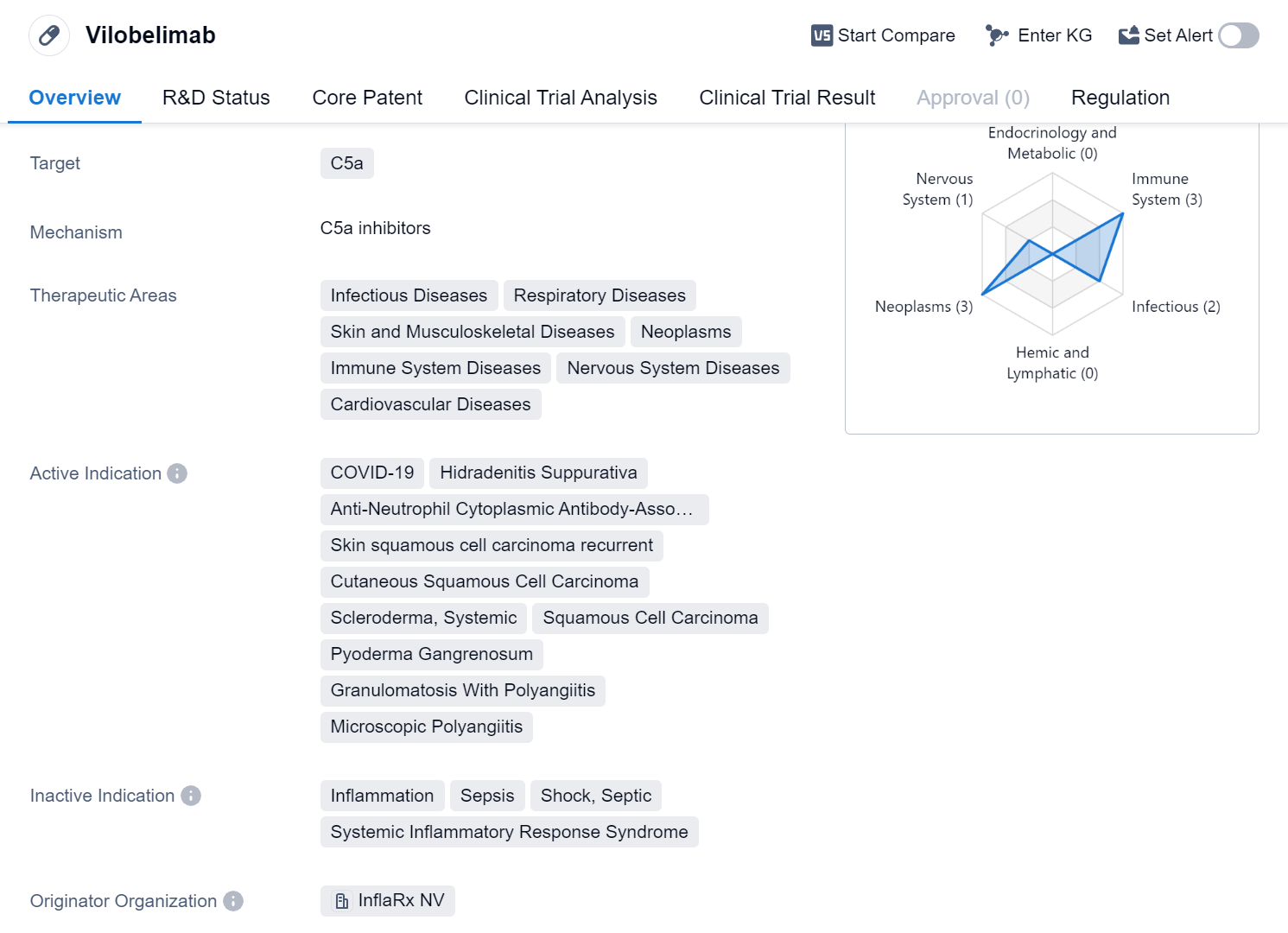
Vilobelimab ist ein chimärer monoklonaler IgG4-Antikörper humanen und murinen Ursprungs, der in Ovarialzellen des chinesischen Hamsters (CHO-Zellen) durch rekombinante DNA-Technologie hergestellt wird.
Vilobelimab bindet an ein Fragment der Komplementkomponente C5 (C5a) und blockiert spezifisch dessen Wirkung. C5a ist Teil des Immunsystems. Hohe C5a-Spiegel können die Lunge in einer Weise schädigen, wie sie bei Patienten mit schwerem COVID-19 zu beobachten ist. Die Blockierung der Wirkung von C5a mindert Schädigungen der Lunge und lässt mehr Sauerstoff ins Blut gelangen.
Medizinische Verwendung
Vilobelimab ist angezeigt zur Behandlung von erwachsenen Patienten mit SARS-CoV-2-induziertem akutem Atemnotsyndrom (ARDS), die systemische Corticosteroide als Teil der Standardbehandlung und eine invasive mechanische Beatmung (IMV) (mit oder ohne extrakorporale Membranoxygenierung (ECMO)) erhalten.
Die Verabreichung erfolgt intravenös als Infusion.
Nebenwirkungen und Anwendungsbeschränkungen
Als häufigste Nebenwirkungen wurden Pneumonie, Herpes simplex, bronchopulmonale Aspergillose und Sepsis beobachtet.
Klinische Prüfung
Die Zulassung erfolgte unter „außergewöhnlichen Umständen“, da aufgrund der Seltenheit der Krankheit angesichts der rückläufigen Phase der COVID-19-Pandemie zum Zeitpunkt der Zulassung keine vollständigen Daten zur Behandlung mit Vilobelimab vorlagen. Jedoch gibt es Hinweise auf einen Nutzen für Patienten mit COVID-19-bedingtem ARDS: in der multizentrischen randomisierten, doppelblinden, placebokontrollierten Phase-3-Studie PANAMO mit 369 invasiv-mechanisch beatmeten Covid-19-Patienten auf Intensivstationen gab es nach 28-tägiger Behandlung in der Vilobelimab-Gruppe weniger Todesfälle als in der Placebogruppe. Jedoch war der Unterschied statistisch nicht signifikant. Nahezu alle Patienten in der Studie wurden zudem mit Antithrombotika und Corticosteroiden behandelt.
Sonstiges
Im Januar 2025 erfolgte die Zulassung für den Europäischen Wirtschaftsraum In den USA erhielt Vilobelimab 2023 eine Notfallzulassung, eine Marktzulassung besteht dort (Stand 2025) nicht.
Nach Angaben aus dem Unternehmen InflaRx wird Vilobelimab ferner untersucht zur Behandlung von Pyoderma gangraenosum, einer schweren entzündlichen neutrophilen Hauterkrankung, die durch schmerzhafte Hautgeschwüre gekennzeichnet ist. Bisher gebe es weder in den USA noch in Europa eine zugelassene Therapie für diese seltene Erkrankung.
Handelsnamen
Gohibic (EU)
Einzelnachweise